Substância iónica- substância constituída por iões positivos e iões negativos
Iões- são partículas com carga eléctrica, que derivam de um átomo ou de um conjunto de átomos
Ião positivo ou catião- deriva de um átomo ou conjunto de átomos que perdeu electrões
Ião negativo ou anião- deriva de um átomo ou conjunto de átomos que ganhou electrões
Olá! Eu sou a Margarida e faço este blogue no âmbito da disciplina de CFQ. Espero que gostem! Se tiverem alguma dúvida ou acharem que algo não está bem comentem!
sábado, 8 de dezembro de 2012
Lei de Lavoisier
Numa reação química, a massa total dos reagentes é igual à massa total dos produtos de reação ( num sistema fechado).
"Na natureza, nada se cria, nada se perde, tudo se transforma". Lavoisier
Moléculas
Molécula- Conjunto de átomos ligados entre si
 1 átomo de oxigénio- O
1 átomo de oxigénio- O
2 átomos de oxigénio (separados)- 2O
1 molécula de oxigénio (é constituída por 2 átomos de oxigénio ligados entre si)- O2
3O- 3 átomos de oxigénio separados
O3-molécula de ozono
3O3-3 moléculas de ozono
30O3-3o moléculas de ozono
Moléculas elementares- constituídas por átomos do mesmo elemento químico
Moléculas compostas-constituídas por átomos de diferentes elementos químicos
Constituição de um átomo
Um átomo é constituído por:
Como num átomo o nº protões=nº electrões então o átomo é uma partícula neutra (ou seja, a carga eléctrica total é zero, ou seja, a carga é nula).
Existem diferentes tipos de átomos, porque existem diferentes tipos de elementos químicos e porque não têm o mesmo número de protões.
- neutrão-sem carga eléctrica
- protão-carga eléctrica positiva
- electrão-carga eléctrica negativa (está na nuvem electrónica)
Como num átomo o nº protões=nº electrões então o átomo é uma partícula neutra (ou seja, a carga eléctrica total é zero, ou seja, a carga é nula).
Existem diferentes tipos de átomos, porque existem diferentes tipos de elementos químicos e porque não têm o mesmo número de protões.
Constituição da matéria
Matéria
Classificada em:- Substâncias puras
- Misturas de substâncias
Constituída por:
- pequenas partículas = corpúsculos
Entre os corpúsculos que constituem a matéria encontram-se os:
- átomos (partícula elementar)
- moléculas (conjunto de átomos ligados entre si)
- iões
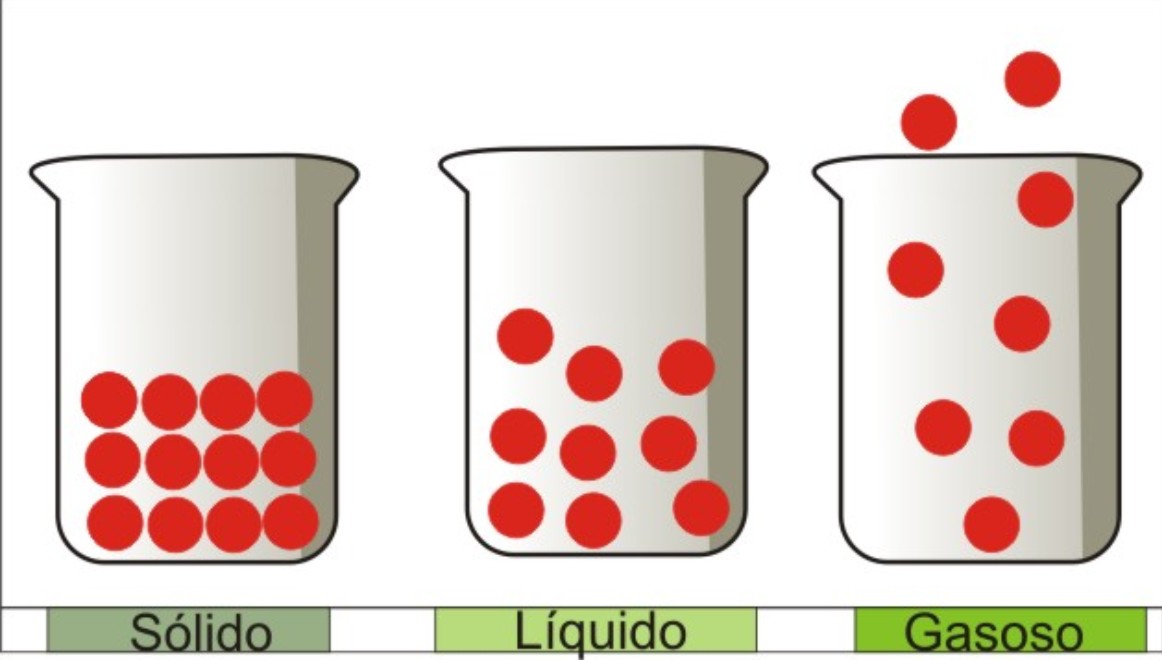
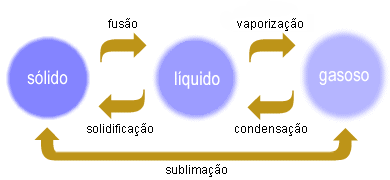
Estados físicos da matéria
Sólido
Os espaços entre os corpúsculos são muito poucos.
Os movimentos entre os corpúsculos são muito poucos.
Existem forças muito fortes entre os corpúsculos.
Os corpúsculos estão organizados.
A forma é constante.
O volume é constante.
A compressibilidade é muito pouca.
Líquido
Os espaços entre os corpúsculos são poucos.
Os movimentos entre os corpúsculos são poucos.
Existem forças fortes entre os corpúsculos.
Os corpúsculos estão pouco organizados.
A forma varia de acordo com o recipiente onde o líquido se encontra.
O volume é constante.
A compressibilidade é pouca.
Gasoso
Existe muito espaço entre os corpúsculos.
Existem muitos movimentos entre os corpúsculos.
As forças entre os corpúsculos são praticamente inexistentes.
Os corpúsculos estão desorganizados.
A forma é variável.
O volume é variável.
Existe muita compressibilidade.
pH
Quando queremos comparar a acidez ou a basicidade de soluções, determinamos o seu pH
Quando o pH de uma solução é igual a 7 esta é neutra.
Quando o pH de uma solução é maior que 7 esta é básica ou alcalina.
Quando o pH de uma solução é menor que 7 esta é ácida.
Quando o pH de uma solução é igual a 7 esta é neutra.
Quando o pH de uma solução é maior que 7 esta é básica ou alcalina.
Quando o pH de uma solução é menor que 7 esta é ácida.
Indicadores Ácido-base
Tinta azul de tornesol
Esta solução tem uma cor azul-arroxeada.Quando se coloca tinta azul de tornesol numa solução ácida, esta reage e fica vermelha.
Solução Alcoólica de Fenolftaleína
Esta solução é incolor.Quando se coloca a solução de fenolftaleína numa solução básica esta reage e fica carmim.
domingo, 2 de dezembro de 2012
Tipos de reações químicas
Soluções Ácidas
As soluções ácidas apresentam as seguintes características:
- têm sabor azedo;
- reagem com os metais, produzindo hidrogénio;
- conduzem a eletricidade;
- alteram a cor de certos corantes vegetais.
Soluções Básicas
As soluções básicas ou alcalinas apresentam as seguintes características:
- têm sabor amargo;
- são escorregadias ao tato;
- conduzem a eletricidade;
- alteram a cor de certos corantes vegetais.
Soluções Neutras
As soluções neutras nem têm caráter químico ácido nem caráter químico básico, ou seja, têm caráter químico neutro.
Indicadores
Os indicadores são substâncias naturais/sintéticas que em presença de uma solução ácida, básica e neutra a sua cor altera-se. Os principais indicadores são a tintura azul de tornesol e a fenolftaleína.
Combustão viva e combustão lenta
QUAL A DIFERENÇA?
A combustão viva tem chama e a combustão lenta não.
A combustão viva tem chama e a combustão lenta não.
Tipos de reações químicas
REAÇÕES DE PRECIPITAÇÃO
Caracterizam-se pela formação de um precipitado, isto é, o sólido que se forma numa reação química.
Solubilidade
O QUE É?
É a quantidade máxima de soluto que se pode dissolver numa certa quantidade de solvente a uma certa temperatura.
Tipos de reações químicas
REAÇÕES DE COMBUSTÃO
Definição de combustão: Uma combustão tem de ter sempre um combustível, um comburente e uma fonte de ignição.
Definição de combustão: Uma combustão tem de ter sempre um combustível, um comburente e uma fonte de ignição.
Reações químicas
O QUE É UMA REAÇÃO QUÍMICA?
É uma transformação química, ou seja, é uma transformação onde se formam novas substâncias.
COMO DETECTAR UMA REAÇÃO QUÍMICA?
- Formação de um gás
- Efervescência
- Cor
- Cheiro
Transformações químicas e transformações físicas
QUAL A DIFERENÇA?
Numa transformação física não há formação de novas substâncias enquanto que numa transformação química há.
Ex de uma transformação física: cortar ou dobrar a folha
Ex de uma transformação química: queimar a folha
domingo, 11 de novembro de 2012
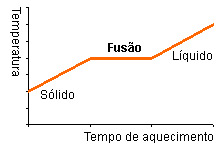
Ponto de ebulição e ponto de fusão
PONTO DE EBULIÇÃO
O ponto de ebulição é a temperatura à qual um líquido entra em ebulição, ou seja, é a temperatura à qual um líquido passa tumultuosamente para o estado gasoso.
PONTO DE FUSÃO
O ponto de fusão é a temperatura a que ocorre a passagem do estado sólido ao estado líquido.
O ponto de ebulição é a temperatura à qual um líquido entra em ebulição, ou seja, é a temperatura à qual um líquido passa tumultuosamente para o estado gasoso.
PONTO DE FUSÃO
O ponto de fusão é a temperatura a que ocorre a passagem do estado sólido ao estado líquido.
quarta-feira, 7 de novembro de 2012
Separação física dos componentes de uma mistura
 Separação magnética
Separação magnética
Este processo é utilizado quando um dos componentes da mistura sólida tem propriedades magnéticas.
Sólido+ Sólido
Exemplo: ferro+areia
Sublimação
Sólido+Sólido
Exemplo: Iodo e areia
 Decantação com ampola
Decantação com ampola
Permite a separação de dois ou mais líquidos de diferentes densidades e imiscíveis.
Líquido+Líquido
Exemplo: Água e azeite
Decantação
Separação de partículas sólidas que se encontram no seio de uma solução ou de um líquido.
Líquido+Sólido
Exemplo:Água e areia
Filtração
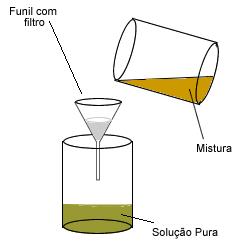 Processo que também permite a separação de um sólido de um líquido ou de uma solução, fazendo passar a mistura por um filtro.
Processo que também permite a separação de um sólido de um líquido ou de uma solução, fazendo passar a mistura por um filtro.
Líquido+Sólido
Exemplo: Água e areia
Centrifigação
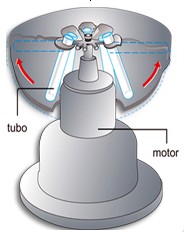 Este processo permite separar, através da rotação a grande velocidade da mistura, as partículas sólidas de pequenas dimensões que se encontram no líquido. Para a separação final do líquido do depósito usa-se a decantação.
Este processo permite separar, através da rotação a grande velocidade da mistura, as partículas sólidas de pequenas dimensões que se encontram no líquido. Para a separação final do líquido do depósito usa-se a decantação.
Líquido+ Sólido
Exemplo: células do sangue
Ebulição do solvente
Técnica de separação que permite a recuperação de um sólido dissolvido num líquido.
Exemplo: água com sal
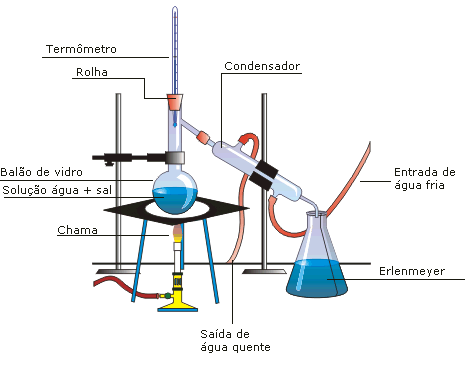
Destilação simples
Técnica de separação que consiste na ebulição de uma mistura no estado líquido.
Exemplo: água com terra
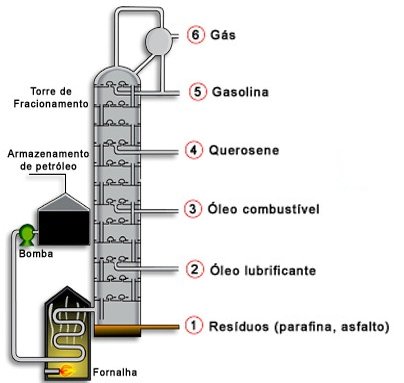
Destilação fracionada
Este processo é utilizado na separação de dois ou mais líquidos com pontos de ebulição muito próximos. Os vapores do líquido que tem menor ponto de ebulição conseguem chegar ao topo da coluna mais rapidamente- este líquido é o primeiro a destilar. Os restantes líquidos destilam por ordem crescente dos seus pontos de ebulição.
Líquido+Líquido
Exemplo: petróleo
Cristalização
Utilizado para recuperar um sólido cristalino que se encontra dissolvido num líquido ou para purificar uma dada substância.
Sólido+ Líquido
Exemplo: cloreto de sódio dissolvido na água
Cromatografia
Técnica utilizada quando existem pequenas quantidades de amostra da mistura e as substâncias que a constituem têm diferentes capacidades de se fixar num material sólido.
Líquido+ Sólido
Exemplo: substâncias de cores diferentes
Subscrever:
Comentários (Atom)